Телеграм канал «Химия ЕГЭ 2026 | Тася Фламель | Вебиум»
Отзывы — @otzyvy_tasya

телеграм-каналов

рекламных размещений, по приросту подписчиков,
ER, количеству просмотров на пост и другим метрикам

и креативы
а какие хуже, даже если их давно удалили

на канале, а какая зайдет на ура

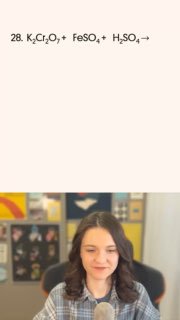
Завершаем неделю разбором реакции с тем же «типичным окислителем» — дихроматом калия
🔜 На роль восстановителя отлично подходит железо в с.о. +2, которое отдав 1 электрон, перейдёт в железо в с.о. +3
❗️Обрати внимание на баланс: если мы составим его в расчёте на 2 атома, то уравнять будет гораздо проще:)
#100ОВР_Тася
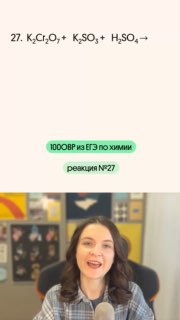
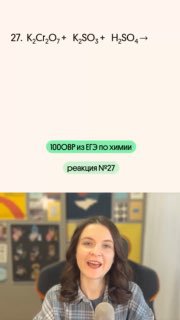
😎 И мы продолжаем разбирать реакции с тем самым «типичным окислителем» — дихроматом калия (как видите, он на ЕГЭ встречается тоже довольно часто)
😎 Восстановителем в этой реакции будет сера в с.о. +4, которая повысит её до +6, перейдя из сульфита в сульфат калия
#100ОВР_Тася
Кто бы что ни говорил, но мы с вами прекрасно знаем: именно мы — та сила, которая движет этот мир вперёд. Мы вдохновляем, создаём, поддерживаем и меняем всё вокруг к лучшему✨
Я искренне горжусь каждой своей ученицей — силой, мудростью, добротой и теми свершениями, которые вы достигаете каждый день при подготовке к ЕГЭ 💐
Не забывайте гордиться собой, своими достижениями и тем путём, который вы проходите!!
Расскажу подробнее, какие плюшки вы заберёте при оплате Фреша полностью 💙
🌹Сам курс Фреш
Ускоренная система подготовки с индивидуальным подходом. Нужно подтянуть неорганику — сделаем упор на этом разделе в первом треке, нужна органика — уделим ей внимание на втором треке, а если важно посвятить время нарешиванию заданий ЕГЭ по всем темам — подойдёт третий трек. Подробнее про курс здесь
🌹 Химический кружок по 34 задаче
За эту задачу можно получить 4 первичных балла!! Заманчиво, да? На моём курсе будет включён кружок по 34 задаче, где мы познакомимся со всеми типами и научимся забирать все 4 балла!
🌹 Узнай вещество по одному признаку: качественные реакции
Суммарно зная тему качественных реакций можно набрать до 10 первичных баллов! Научимся решать задания №6, 24,30,31
🌹 Химия металлов и неметаллов
То, что нужно ОБЯЗАТЕЛЬНО выучить, чтобы набрать 60+ баллов. Разберём химию отдельных элементов и поймём, как решать вторую часть
Напомню, каждый год курс Фреш помогает набрать 45+ баллов за три месяца!!
[уже прибавили к своим результатам мои мартовские ученики]
I поток «изучаем неорганику»:
• строение атома — задание №2 (1 балл)
• химическая связь — задание №4 (1 балл)
итог: научились уверенно решать целых 2 задания ЕГЭ, 2 первичных балла
II поток «изучаем органику» +
III поток «повторяем все темы»:
• строение атома и электронная конфигурация атома — задание №2 (1 балл)
• типы химических связей — задание №4 (1 балл)
• структура основных классов органических веществ — задание №5 (1 балл)
• валентность и степень окисления — задание №3 (1 балл)
• типы кристаллических решёток — задание №4 (1 балл)
• периодический закон — задание №2 (1 балл)
итог: освоили и научились решать 5 заданий ЕГЭ, 5 первичных баллов
😕 хочу выбрать поток и получить скидочку
😳 хочу задать вопросики менеджеру
❤️ — ощущается как выход из зимней спячки. всем советую!!
💔 — стыдно, но я до сих пор не записался(-ась)
🔥 — начал(-а) подготовку с Основы/Экстры